熱線:021-56056830,66110819
手機:13564362870


熱線:021-56056830,66110819
手機:13564362870
電化學技術(shù)具有很高的空間和時間分辨率,因此在記錄體內(nèi)化學信號方面取得了很大進展。使用鎢絲、鉑絲和金絲等金屬電極的傳統(tǒng)電化學傳感器已被廣泛用于監(jiān)測大腦中的化學信號。然而,這些電極由于其硬度可能會引起免疫反應(yīng)和信號漂移。最近,科學家開發(fā)了用于體內(nèi)電化學記錄的柔性電極材料,如水凝膠。雖然水凝膠具有更好的組織彈性匹配性,但目前的柔性電極很難自支撐地植入大腦,因此需要額外的輔助設(shè)備(如注射器)才能進入大腦深部區(qū)域,造成嚴重的物理損傷。此外,水凝膠的導電性差以及表面功能化方面的挑戰(zhàn)也阻礙了基于水凝膠材料的體內(nèi)電化學傳感器在化學信號監(jiān)測方面的發(fā)展。
華東師范大學田陽教授團隊近期創(chuàng)制了一種具有高生物相容性的自支撐植入式聚合物微電極(rGPF),實現(xiàn)了自由行為動物大腦中的Mg2+和Ca2+的同時監(jiān)測和實時量化。通過在還原氧化石墨烯(rGO)中摻入了導電性聚苯胺(PANI),形成了直徑約800 nm的rGPF超細電極。與傳統(tǒng)的金屬絲和碳纖維相比,rGPF表現(xiàn)出優(yōu)異的生物相容性和最小的物理損傷,這歸功于rGPF較低的楊氏模量。盡管直徑較小,但它仍表現(xiàn)出足夠的彎曲剛度,可直接自支撐植入小鼠腦深部區(qū)域,無需外部輔助裝置,從而降低了額外物理損傷的風險(圖1)。
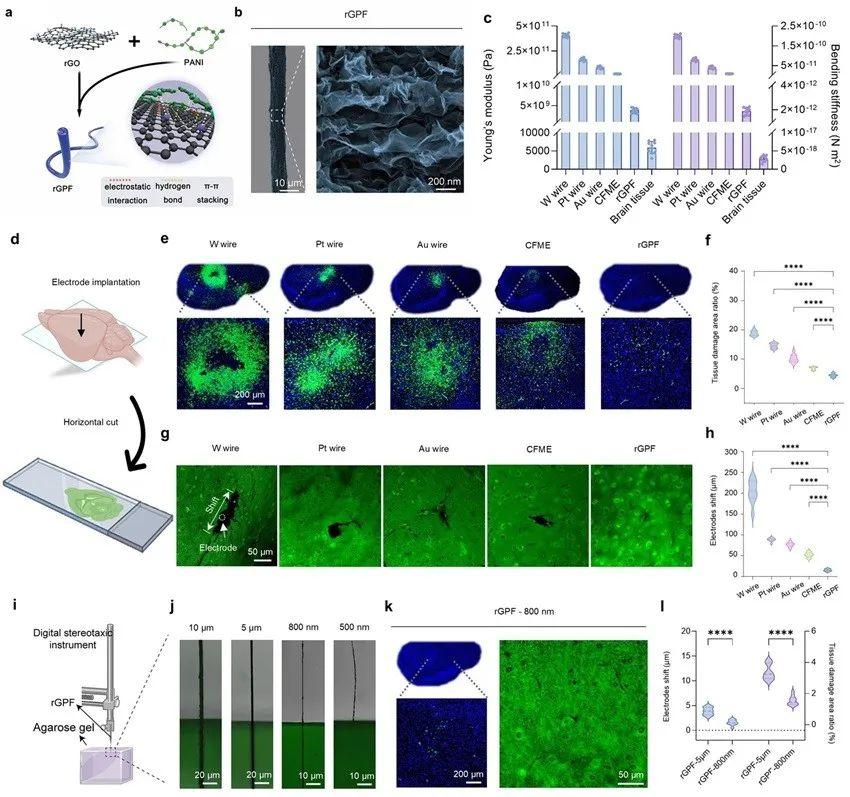
圖1.自支撐柔性聚合物電極rGPF的設(shè)計和機械特性分析。
另一方面,由于Mg2+和Ca2+在神經(jīng)信號傳導和突觸可塑性中起著關(guān)鍵作用,該工作將它們作為研究模型,設(shè)計了一系列離子選擇性配體,通過密度泛函理論(DFT)計算進行篩選。隨后,合成了兩種優(yōu)化的特異性離子配體(MPETH-1和PPETH-5),高選擇識別Mg2+和Ca2+,并利用π-π堆疊相互作用自組裝到電極表面,構(gòu)建了Mg-E和Ca-E電化學傳感器。Mg-E和Ca-E在識別Mg2+和Ca2+方面具有顯著的選擇性、良好的可逆性、快速的反應(yīng)時間和90天連續(xù)測試的穩(wěn)定性(圖2)。
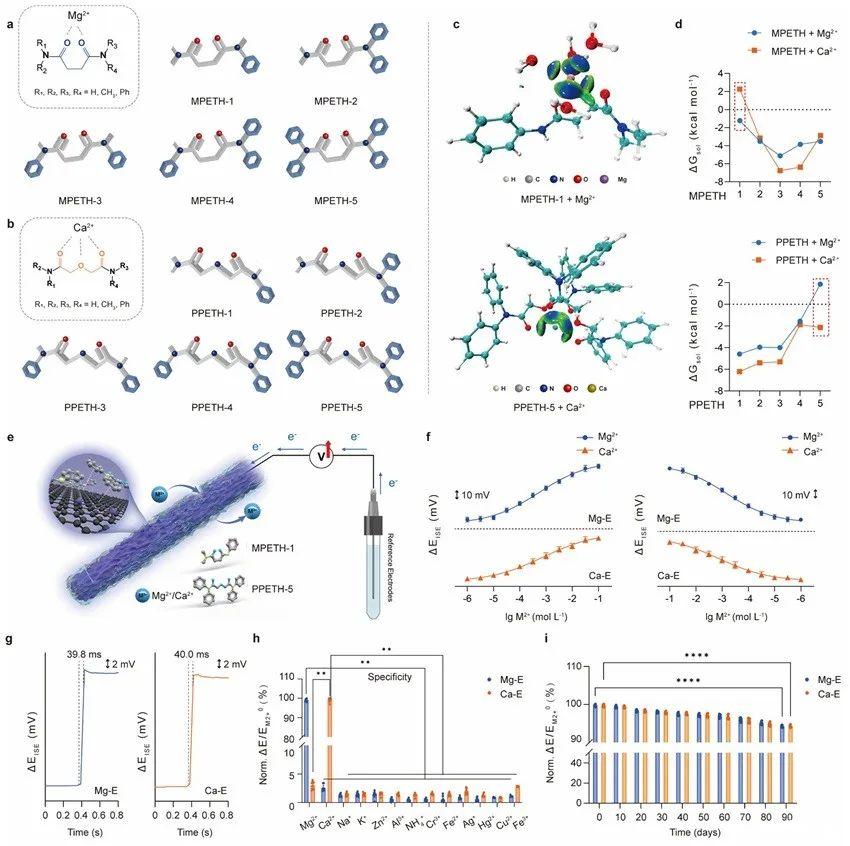
圖2.Mg2+和Ca2+可逆探針的設(shè)計和Mg-E,Ca-E傳感器的電化學性能。
利用這一強大的工具,在體外4-氨基吡啶(4-AP)的誘導下,首次觀察到Mg2+的變化先于Ca2+,以及Mg2+對Ca2+內(nèi)流的拮抗作用(圖3)。此外,由于采用了無額外電流的電位測量法,Mg-E、Ca-E、內(nèi)參比電極和電生理電極被集成到了一個微電極束中,可按需植入目標腦區(qū)而不會發(fā)生串擾。最終發(fā)現(xiàn),癲癇發(fā)作時細胞外Mg2+和Ca2+的初始變化時間與神經(jīng)通路相一致,在上游腦區(qū)添加Mg2+可抑制下游腦區(qū)的Ca2+流入和癲癇樣放電活動(圖4)。該結(jié)果被田陽教授團隊首次報道。
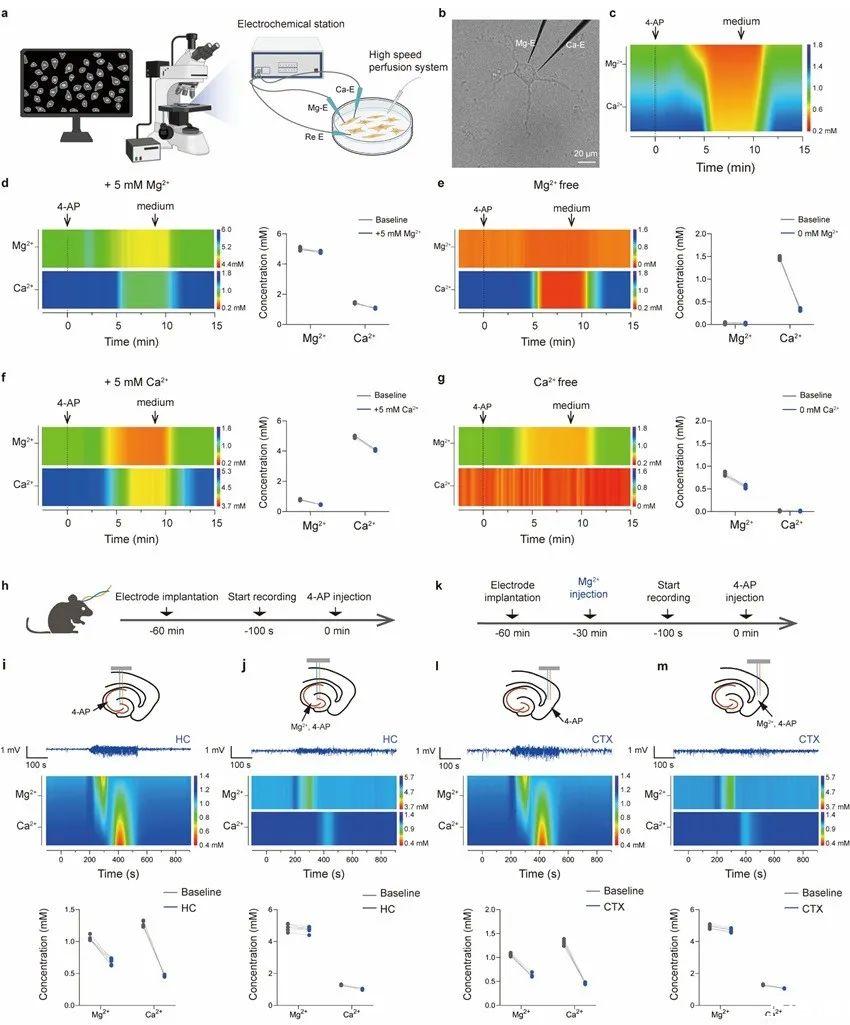
圖3.實時監(jiān)測細胞外Mg2+和Ca2+在4-AP作用下的動態(tài)變化。
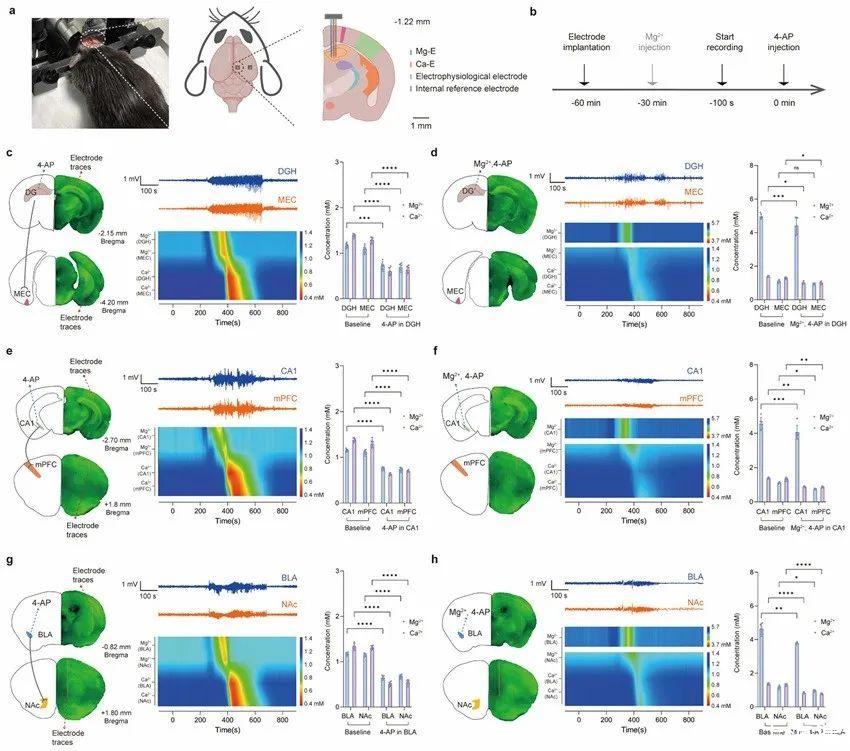
圖4.神經(jīng)通路中Mg2+和Ca2+的體內(nèi)追蹤。
小結(jié)
該研究為實時跟蹤和量化大腦化學物質(zhì)的動態(tài)變化開辟了新途徑,展現(xiàn)了自支撐柔性聚合物電極在高生物相容性植入設(shè)備開發(fā)中的潛力。通過擴展優(yōu)化策略,可設(shè)計更多配體識別多種神經(jīng)化學物質(zhì),從而深入解析其對大腦功能和神經(jīng)健康的影響。這一方法將推動腦機接口、神經(jīng)科學及生物電子醫(yī)學的發(fā)展,為揭示大腦事件與疾病機制提供新見解。相關(guān)成果近期發(fā)表在Angewandte Chemie International Edition上。論文的第一作者為華東師范大學在讀博士研究生王詩迪,論文的共同通訊作者為劉原東博士和田陽教授。該研究得到了國家自然科學基金、上海市教委創(chuàng)新計劃、2022年上海市“科技創(chuàng)新行動計劃”基礎(chǔ)研究項目的支持。
 相關(guān)新聞
相關(guān)新聞