熱線:021-56056830,66110819
手機:13564362870


熱線:021-56056830,66110819
手機:13564362870
本文介紹了pH值測量的原理,描述了測定KCl/NaCl樣品pH值時純水、攪拌、pH電極的維護保養對測量結果的影響。分析了出現這些結果的主要原因,并通過選取標樣對測量結果修正、讀取穩定數值、合理使用、正常保養電極的方法,解決了測量結果重復性差、耗時長,多個試驗結果不一致的問題。
KCl/NaCl在醫學、化工等領域有很多的應用,在鈉還原氟鉭酸鉀制取鉭粉工藝中,常常采用KCl/NaCl作為稀釋劑,改善鉭粉的粒度、粒形及其它電氣性能[1~7]。專利特開2004-156060中公開了KCl/NaCl中水分對鉭粉中Fe、Ni、Cr等金屬雜質的影響。pH值作為KCl/NaCl原材料關鍵控制指標,對鉭粉的金屬雜質影響也較大。因此做好pH值的檢測工作尤為重要。
不同領域對KCl/NaCl的控制標準不同,目前在對KCl/NaCl樣品進行pH值測定時,經常出現的問題是:測量結果重復性差、耗時長,多個試驗結果不一致等。本文通過試驗分析出影響檢測結果的多個影響因素,并對影響因素進行消除,最終確定了用于日常分析的檢測方法。結果重現性好,檢測時間大幅縮短。
1試驗
1.1主要儀器與試劑
FiveEasy實驗室pH計,上海梅特勒托利多儀器有限公司;PH電極,丹麥Unisense;MS-70水份烘干儀。
1.2試驗方法及過程
選用梅特勒公司自產的pH值分別為4.01,7.00的二種校準液,放至室溫,按照設定的程序對pH計進行校準,零點在0 mv±30 mv,斜率在95%~100%后方可測量。稱量5 g樣品,倒入燒杯中,用量筒量取100 mL純水溶于待測樣品。攪拌樣品至完全溶解。用純水洗滌電極,濾紙擦試干凈后,將電極插入待測樣品溶液,輕輕攪動溶液,當自動終點圖標出現時讀取pH測量值。試驗過程采用ATC溫度自動補償模式。
2結果與討論
2.1 pH值的測量原理
溶液的pH值是表示溶液中氫離子活度的負對數,表示為pH=-lg[H]+[8],由于水溶液中氫離子活度的數值往往很小,在應用上很不方便,所以就用pH值這一概念來作為溶液酸性、中性和堿性的判斷指標。所使用的KCl/NaCl原材料,其KCl的pH值為5.0~8.0[9],NaCl的pH值為6.8~7.2[10]。由于溶液中H+離子濃度非常低,而參比電極鹽橋溶液中高濃度的KCl相互之間的濃度差較大,低濃度的H+離子會加大鹽橋溶液的滲透速度,促使鹽橋的損耗,從而加速了K+和Cl-的濃度的降低[11]。結果電極響應遲鈍,出現pH值漂移的現象,因此電極未使用時需浸泡在3 M KCl溶液中對電極進行保護。
2.2純水對測試結果的影響
理論上純水為中性溶液,其pH值為7,但是敞開在空氣中的純水很容易因吸收CO2,pH值出現變化。試驗表明,對于純水,讓其暴露在空氣中測量它的電阻值的變化,會發現剛開始時的電阻的變化很大,放置約1 h后,達到了平衡,其平衡方程式為:
由于生產現場的純水的pH值會有波動,在同一時間點取水稱為相同純水體系,不同時間點取水為不同純水體系。表1表明,同一樣品在相同純水體系暴露在空氣中不同時間間隔(間隔1 d)的pH值測試結果,其值最高相差0.5。表2表明,同一樣品連續在相同純水體系下測量時間間隔3 min其pH值相差0.03,為了消除相同純水因放置時間對測試結果的影響,應盡快在相同的純水體系下測試樣品。同樣,取用不同純水體系,溶解待測樣品,表3表明,同一樣品在不同純水體系的pH值最高相差0.28。為了消除不同純水體系對pH值測量結果的影響,表4表明,按照藥典三部(2015版)通則-0631pH值測定法的方法,將純水放入燒杯中煮沸后,降至室溫,用無CO2水溶于樣品,消除不同純水體系的差異,同一樣品的測量結果相差0.02以內,符合測試要求。此種方法雖然滿足生產要求,但耗時較長。采用上述方法測試某一KCl/NaCl樣品,其測試結果作為標樣的標定值,在測量不同的樣品時,可取用不同的純水體系,對不同樣品進行數據檢測。測量同一純水體系下標樣的pH值,即樣品的pH修正值=樣品pH實測值+標樣標定值-標樣實測值。表5表明,樣品的測量結果與采用藥典三部(2015版)通則-0631的測試方法的測量結果的pH值相差只有0.03,符合測試要求,同時該方法耗時短,操作靈活,符合生產現場的pH值檢測。同時試驗探討了放置在密封袋內的標樣的放置時間對標定值的影響,
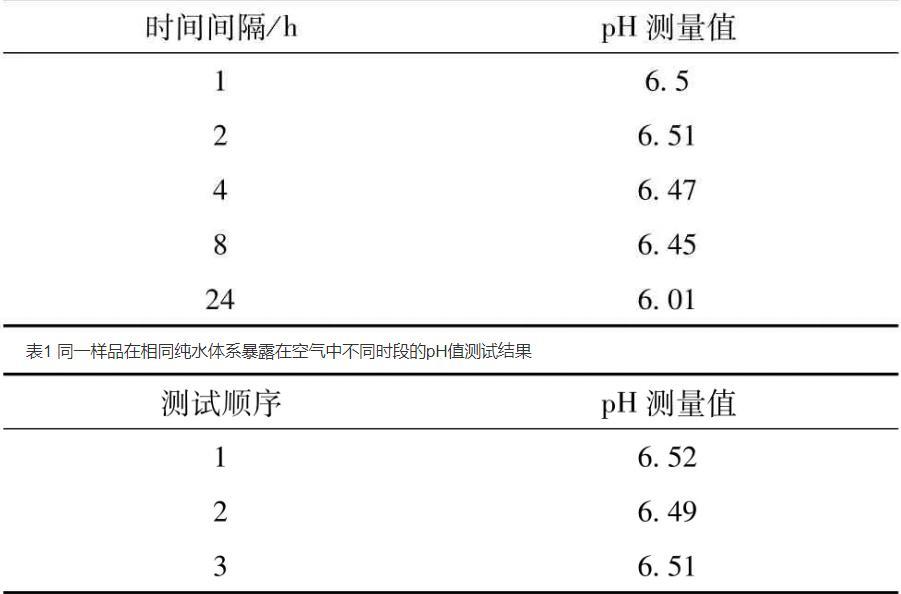
表1同一樣品在相同純水體系暴露在空氣中不同時段的pH值測試結果
表2同一樣品連續在相同純水體系下pH值測試結果
表6表明標樣放置到第7個月時pH值有明顯變化,應在標樣放置在第六個月時重新選取標樣。
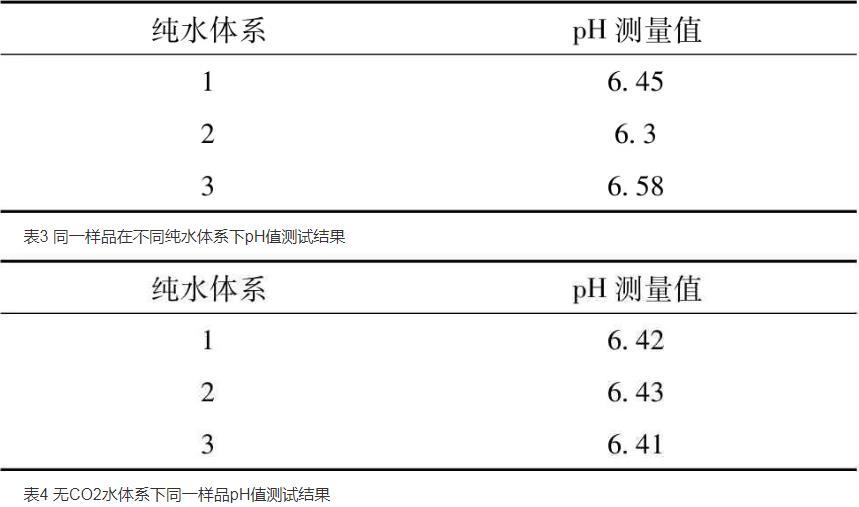
表3同一樣品在不同純水體系下pH值測試結果
表4無CO2水體系下同一樣品pH值測試結果
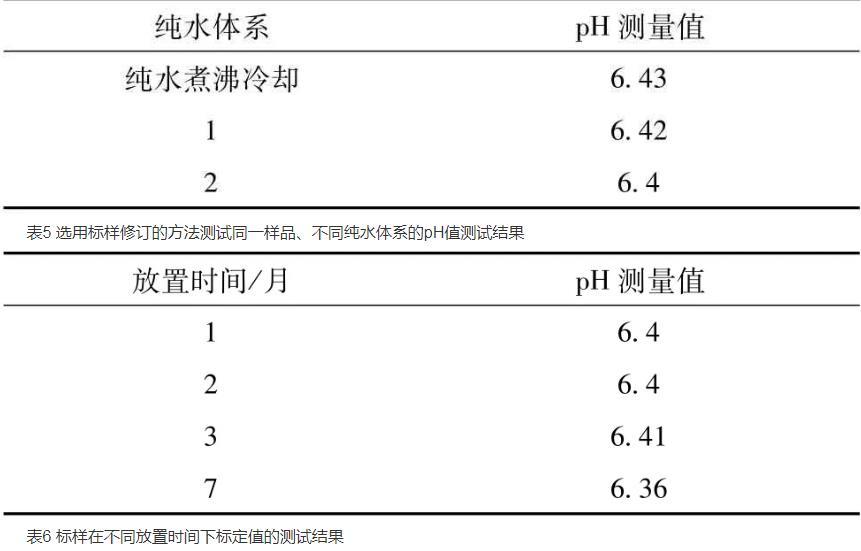
表5選用標樣修訂的方法測試同一樣品、不同純水體系的pH值測試結果
表6標樣在不同放置時間下標定值的測試結果
2.3測量時攪拌因素的影響
由于復合電極液接界很靠近pH敏感玻璃泡,從液接界滲漏出的鹽橋溶液首先聚集在敏感球泡周圍,改變了其附近的總離子濃度,由上述原因可知,測得的pH值只是敏感球泡附近的被改變了的pH值,不能反應其真實的pH值。因此pH計電極浸沒在樣品溶液中,輕輕地攪動,直至pH讀數在0.01個pH單位變動時,停止攪動,等待讀數穩定[13]。表7表明,攪拌時間越長,pH越小,攪拌至150 s時讀數穩定。其穩定的讀數與未采用攪拌方式穩定讀數的結果相比,pH相差只有0.03,結果表明保證pH讀數穩定的方式,攪拌對測量結果無影響。

表7攪拌對測量結果的影響
2.4 pH電極對測試結果的影響
目前pH計上配套使用的大多數是復合電極,分為封閉式與非封閉式。pH測量中,許多測量值不準確的問題都和電極有關,如測量不精確或響應緩慢、讀數不穩定、讀數超范圍、信號不改變、無法進行多點校準等。電極對pH測量結果產生的影響可能主要有以下方面:電極在使用前未充分浸泡,對樣品中的H+響應不靈敏,同時引起不對稱電位增大;電極玻璃薄膜球泡內部有空氣泡,使讀數不穩定;電極的外參比部分出現問題,包括外參比液污染,長期使用過程中KCl流失、液接界堵塞等[14]。日常使用需1 a左右更換一次電極。表8表明將pH電極敏感膜裸露在空氣中20 h條件下,同一樣品的測試結果不穩定,同一樣品相差0.4左右,需要放在0.1 M HCl溶液中活化。因此合理使用、正常保養電極,尤為重要。

表8 pH電極敏感膜裸露在空氣中20 h條件下同一樣品的pH測試結果
3結論
通過選取標樣對測量結果修正的方法,消除相同純水體系不同時段及不同純水體系對測量結果的影響,其pH值相差只有0.03,其操作方法耗時短、操作靈活。
采用pH讀數穩定的方式,攪拌對測量結果無影響;合理使用、正常保養電極,消除電極對測量結果的影響很重要。