熱線:021-56056830,66110819
手機:13564362870


熱線:021-56056830,66110819
手機:13564362870
電化學影響下的縫內離子濃度
由于縫隙內只存在氧氣的還原反應,并且產生OH-,溶液中的陰離子和陽離子會發生遷移以保持電中性原則。如圖5所示,可以更直觀地展現出金屬陽離子在溶液中的濃度變化情況。模擬結果表明,在距縫口約30 mm處Na+濃度達到峰值,約為外部溶液濃度的6.6倍,隨著縫隙深度的增加,Na+濃度急劇降低,在縫隙最深處Na+濃度的最小值和縫隙外部的保持一致。縫隙深處由于縫隙過于狹窄,Na+的擴散速率急劇降低,因此無法向縫內傳質,Na+的遷移導致陰極電流無法到達縫隙深處,影響了陰極保護的效果。
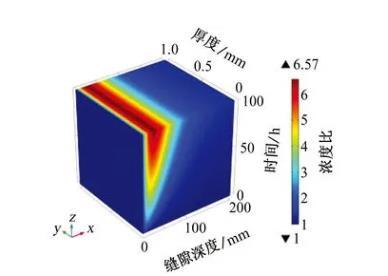
圖5縫內Na+濃度與初始條件下Na+濃度的比值隨時間和縫隙深度的變化
根據電中性條件的假設,隨著縫隙內OH-濃度的增加,SO42-應向縫隙外部遷移,從圖6中可以看出,縫隙深度為0~25 mm,SO42-濃度比下降到0.3以下,最低值為0.12。可見陰離子濃度受傳質效應控制,縫隙口的電位梯度大,并且縫口與縫隙外部溶液中離子的擴散傳質受縫隙形狀影響較小,所以SO42-濃度迅速下降。在縫隙深處由于受到環境限制,SO42-濃度變化較慢。
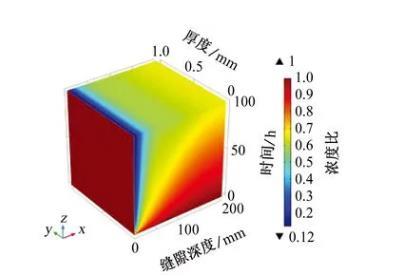
圖6縫內SO42-濃度與初始條件下SO42-濃度的比值(簡稱濃度比)隨時間和縫隙深度的變化
根據以往的模擬和試驗結果,由于溶液保持電中性,Na+向縫隙內部遷移,同時向縫隙外部擴散,Na+濃度與OH-濃度近似相等,這與本模型的模擬結果基本一致。
溶液電導率的影響
模型中電導率(σ)可以用如下方程表示

從上式中了解到,溶液的電導率與陰陽離子濃度密切相關,從圖7中可以直觀地看出縫內溶液電導率的變化,縫隙中電導率整體呈現上升趨勢,且隨著時間的增加而增加、隨深度的增加而減小,這與WANG等的試驗結果相一致。根據前面章節的數據分析,由于縫隙內發生了氧氣的還原反應,造成了OH-濃度的升高,為了保持縫內溶液的電中性,陽離子(Na+)向縫內遷移,陰離子(SO42-)向縫外擴散,因此在縫口處的離子傳質運動劇烈,造成電解質溶液電導率大大增加,最大值約為本體溶液的4.2倍。但是縫隙底部的電位梯度和電流密度遠遠小于縫隙口附近的,所以電導率雖然因離子的傳質而增加但是遠沒有縫口附近電導率增加的快。與此同時,由于受到縫隙形狀和電位梯度的限制,Na+和SO42-只能在距縫口大約100 mm有限距離內進行傳質運動。綜上分析可知,電解質電導率的模擬結果與前幾節得到的結果一致。
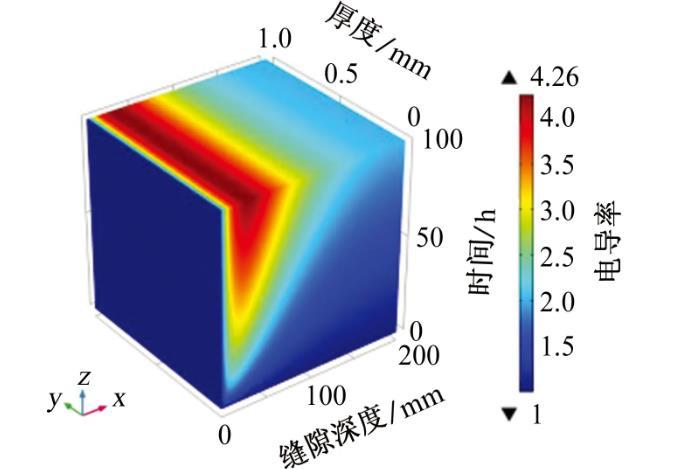
圖7溶液電導率與初始條件下溶液電導率的比值隨縫隙深度和時間的變化
模擬計算結果與試驗測量結果的比較
本工作參考了CHEN等的試驗研究,并與之進行比較,以說明模擬的準確性。試驗采用X70管線鋼,試驗條件如下:以0.01 mol/L Na2SO4溶液作為土壤模擬溶液,pH為6.8,溫度為室溫(22℃),縫隙深度為30 cm,厚度為0.9 mm,陰極保護電位為-1 000 mV。
如圖8、圖9和圖10所示,通過數據對比,模擬結果和試驗結果的平均誤差為1.8%,這種偏差可能是模型的假設與實際情況仍存在差距所致。
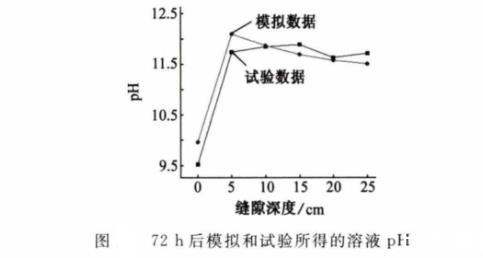
圖8 72 h后模擬和試驗所得的溶液pH
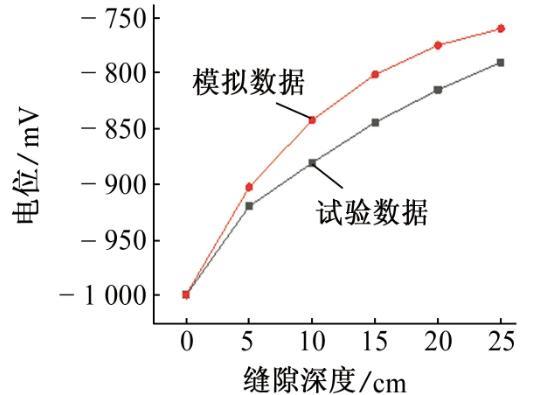
圖9 72 h后模擬和試驗所得的縫內電位
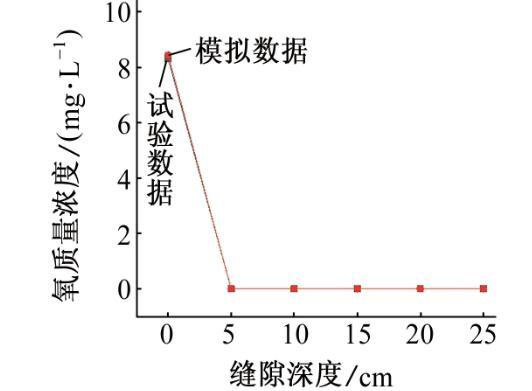
圖10 72 h后模擬和試驗所得溶液的氧質量濃度
結論
(1)在結合前人的數學模型的基礎上,開發了一個涂層下縫隙腐蝕的二維瞬態模型,將縫隙內化學物質的傳質、還原反應和水的電離統一,利用有限差分法解決了方程的求解問題,模擬了陰極保護條件下,縫隙內化學和電化學反應隨時間的演變,模擬結果與試驗數據吻合度較好,兩者平均誤差為1.8%。
(2)當縫內溶液含有溶解氧時,縫內發生氧的還原反應,氧氣被消耗,在有陰極保護電流的情況下,在距縫口1.5 mm處溶液pH出現峰值,此處氧氣被消耗殆盡,并且由于電中性和縫隙形狀的特殊性,使得氧氣無法進一步向縫內擴散。
(3)本模型添加水的電離效果,當溶解氧被還原生成OH-的同時還有少部分OH-來自水的電離,這使模擬效果更佳貼合實際。在陰極保護條件下,縫內溶液的pH顯著上升,在縫隙口處達到峰值,并隨著時間的推移逐漸趨于穩定。而在高堿性環境中,縫隙內部的金屬表面會形成鈍化膜從而使其腐蝕速率降低,即使縫隙深處未受到陰極保護也能延緩腐蝕的發生。
(4)縫隙中由于電遷移傳質和濃度梯度影響下的擴散,使陽離子向內、陰離子向外運動,同時由于還原反應使縫口處OH-濃度迅速升高,導致溶液電導率隨時間的延長而增加,并且隨著深度的增加而減小。