熱線:021-56056830,66110819
手機:13564362870


熱線:021-56056830,66110819
手機:13564362870
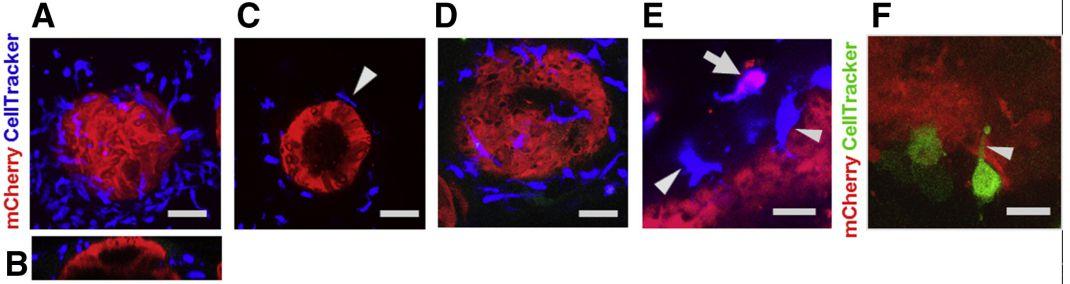
圖2、MoDCs直接與共培養的胃球上皮細胞結合。將細胞追蹤器標記的MoDCs加入表達mCherry的胃球形細胞培養物中。48小時后,在Leica SP5激光共聚焦掃描顯微鏡上使用63×水浸物鏡對培養物進行固定和成像。(A-C)遷移到胃上皮球體(紅色)基外側的細胞追蹤DeepRed標記MoDCs(藍色)。比例尺:50μm。(A)XY圖像,57個單獨圖像的最大Z投影,步長為1μm。(B)同一球體的XZ投影。(C)單張XY切片顯示了直流電(箭頭)與球面之間的物理聯系。(D)6個相鄰切片的Z向投影顯示胃球表面廣泛的樹突形成。(E)高分辨率圖像顯示,CellTracker DeepRed標記的MoDCs(藍色)與胃上皮細胞(箭頭)直接接觸,1個MoDC內含mCherry+胃上皮細胞物質(合并圖像中為粉紅色;箭頭)。(F)細胞追蹤綠標記的MoDC(綠色)將樹突(箭頭)延伸至上皮細胞層(紅色)。
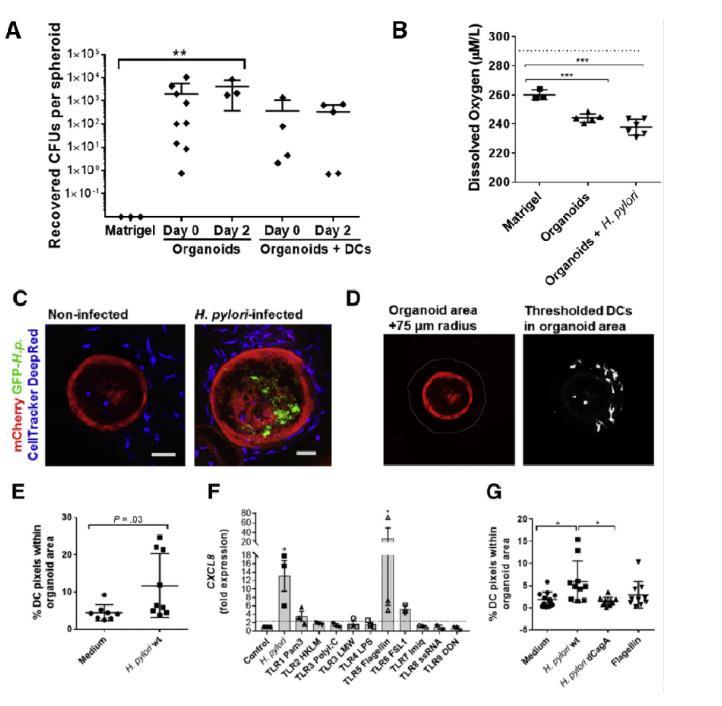
圖3、幽門螺桿菌感染人胃上皮細胞球導致DC募集增加。(A)從單獨的Matrigel或幽門螺桿菌感染的胃球形培養物(20-50個/培養物)(有或沒有共培養的MoDCs)中回收細菌。(B)微電極分析胃球體內測得的管腔氧濃度(n=5或6個有機體,均數±標準差)。虛線表示緩沖液中的氧氣濃度。(C)未感染和感染GFP-幽門螺桿菌(綠色)、表達mCherry的胃球形體(紅色)與CellTracker標記的MoDCs(藍色)共培養48小時的代表性共聚焦圖像(單個光學切片)。(E)對3個獨立實驗中8個未感染和9個感染了GFP-幽門螺桿菌的球狀體共培養物的數字圖像分析。圖中顯示了單個數據點的平均值±SD。(F)將胃上皮球形細胞復制為單層細胞,并用幽門螺桿菌60190野生型(wt,5×107個/孔)或一系列TLR激動劑(見“材料與方法”部分)處理6小時。(G)胃球體微注射單獨的FITC右旋糖酐(分子量4千道爾頓,示蹤劑)或含有幽門螺桿菌60190野生型、幽門螺桿菌60190ΔCagA或沙門氏菌鞭毛蛋白(1μg/ml)的FITC右旋糖酐。
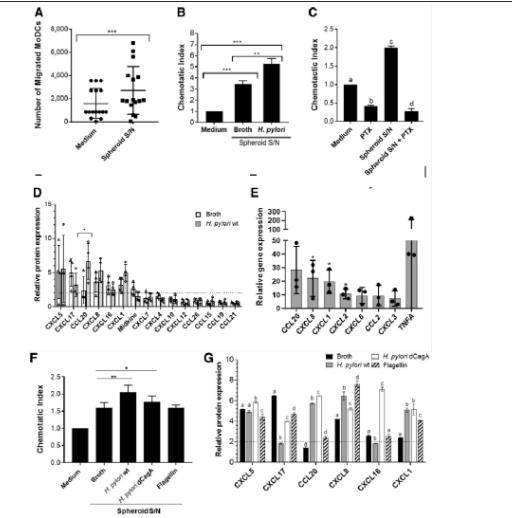
圖4、幽門螺桿菌感染會增加人胃上皮細胞趨化因子的表達,導致直流電募集增強。(A)在Transwell趨化試驗中,檢測從已建立的球形培養物中收集48小時以上的培養上清(S/Ns)吸引MoDCs(2×105個/孔)的能力。(B)從感染或未感染幽門螺桿菌的胃小球中收集的培養上清液在小球顯微注射48小時后與MoDCs(1×105個/孔)一起在Transwell趨化試驗中進行分析。(C)分析了MoDC在存在或不存在百日咳毒素(PTX,10μg/mL)的情況下對單獨培養基或胃球上清的趨化性。圖中顯示的是一式三孔的平均值±SD,3個實驗中有1個具有代表性。(D)利用趨化因子陣列分析從感染幽門螺桿菌和未感染幽門螺桿菌(48小時)的球形培養物中收集的上清液中是否存在趨化因子。(E)幽門螺桿菌感染球體與非感染球體中部分趨化因子和細胞因子基因的相對基因表達。(F)48小時后,收集胃球微注射肉湯、幽門螺桿菌野生型(wt)、幽門螺桿菌ΔCagA或沙門氏菌鞭毛蛋白的培養上清。(G)用趨化因子陣列分析不同處理的球形培養物上清液中是否存在趨化因子。
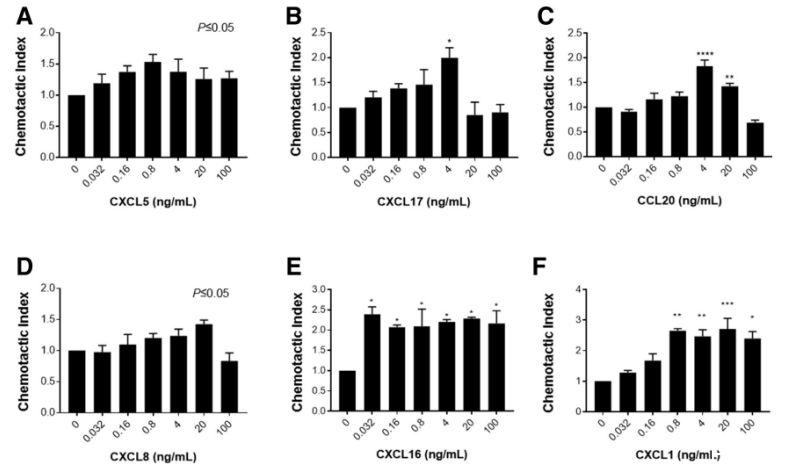
圖5、MoDCs對胃上皮釋放的多種趨化因子具有趨化活性。Transwell趨化試驗分析了MoDCs對不同濃度的(A)CXCL5、(B)CXCL17、(C)CCL20、(D)CXCL8、(E)CXCL16和(F)CXCL1的趨化活性。圖中顯示了3個或更多實驗的代表性結果。一式三孔的平均值±SD,采用單因素方差分析。
結論與展望
本研究通過新型胃球共培養模型揭示了胃上皮細胞在幽門螺桿菌感染下通過趨化因子依賴性機制主動募集樹突狀細胞的現象。這一發現不僅為理解胃黏膜免疫反應提供了新的視角,還為開發針對幽門螺桿菌感染的新型免疫治療策略提供了理論基礎。研究結果強調了胃上皮細胞在免疫監視中的重要作用,并為研究其他胃腸道病原體與宿主免疫系統的相互作用提供了新的思路。本研究的創新之處在于開發了一種能夠模擬胃黏膜生理環境的共培養模型,該模型不僅允許免疫細胞與胃上皮細胞的直接相互作用,還能夠支持幽門螺桿菌的長期感染。這一模型為研究胃黏膜免疫反應提供了新的工具,并為理解幽門螺桿菌感染的免疫機制提供了新的視角。研究結果表明,胃上皮細胞在穩態和感染狀態下均能夠通過分泌趨化因子主動募集DCs,這一過程在幽門螺桿菌感染時顯著增強。這些發現為開發針對幽門螺桿菌感染的新型免疫治療策略提供了理論基礎,并為研究其他胃腸道病原體與宿主免疫系統的相互作用提供了參考。
unisense微電極通過精確測量胃球體內的氧濃度,幫助研究人員模擬了幽門螺桿菌的生長環境,驗證了胃球體模型的生理相關性,并為實驗設計提供了重要依據。通過Unisense微電極測量數據,研究人員發現胃球體內的腔隙氧濃度顯著低于周圍環境(如Matrigel基質),這種低氧環境可能有助于幽門螺桿菌的生存和繁殖。這一發現解釋了為什么幽門螺桿菌能夠在胃球體內部持續存活,而直接注入Matrigel中的細菌則無法存活。這一技術的應用不僅增強了研究的科學性和準確性,還為理解幽門螺桿菌感染的機制提供了新的視角。