熱線:021-56056830,66110819
手機:13564362870


熱線:021-56056830,66110819
手機:13564362870
Cu2+對NH4+-N、NO3變化的影響?-N、NO2號?-N、和SOP在一個周期內
圖2a中的數據表明,在一個厭氧-低溶解氧循環中,對照反應器中NH4+-N的變化與添加Cu2+的反應器中的變化幾乎相同,表明Cu2+對硝化作用沒有明顯影響(p>0.05)。還發現,在Cu2+濃度為100μg/L時,SOP的平均釋放和吸收分別為54.8和66.1 mg/L,幾乎與對照試驗中觀察到的結果相同(54.3和65.4 mg/L)(圖2b)。如圖2所示,兩種NO2?-N和NO3?-在厭氧階段未檢測到氮,但在低溶解氧階段,其濃度隨時間增加。在整個低溶解氧期間,NO3的濃度沒有顯著差異?-氮在兩個反應器之間(p>0.05),但添加100μg/L的Cu2+會引起NO2?-氮積累量比對照低38.9%。Catalan Sakairi等人(1997)還發現,將Cu2+添加到60μg/L的濃度可以最小化NO2?-海水生物脫硝過程中氮的積累,但其機理尚未討論。在本研究中,降低NO2的原因?-在接下來的文本中討論了添加Cu2+的反應器中低溶解氧階段的氮積累。
Cu2+對PHA、糖原和SOP轉化及活性污泥生長的影響
在厭氧-低溶解氧BNR過程中,在厭氧期間觀察到SOP釋放、PHA合成和糖原降解,在隨后的低溶解氧階段,PHA被氧化以吸收磷、反硝化、細胞生長和補充糖原。從表2可以看出,兩種SBR之間PHA和SOP的轉化和細胞生長沒有顯著差異(p<0.05)。顯然,磷累積生物的活性不受Cu2+添加的影響。然而,添加Cu2+導致厭氧或低溶解氧階段的糖原轉化比對照低約25%。
表2添加100μg/L Cu2+對厭氧-低DO BNR過程中PHA、SOP和糖原轉化以及活性污泥生長的影響
銅離子對反硝化酶活性的影響
反硝化是一種包含四個步驟的金屬酶途徑(電子補充材料,圖S8)。NO3號?還原酶(NAR),NO2?還原酶(NiR)、NO還原酶(NOR)和N2O還原酶(N2OR)是反硝化的四個關鍵酶。眾所周知,亞硝酸鹽和N2O的積累分別取決于硝酸鹽和亞硝酸鹽還原以及NO和N2O還原的相對速率(NO3?→NO2號?→不→氧化亞氮→N2)。如圖3a所示,與對照組的0.367 mg N/g MLVSS/min相比,在100μg/L的Cu2+濃度下,NiR活性增加到0.72 mg N/g MLVSS/min,而NAR活性與對照組相比沒有顯著影響(0.49 mg N/g MLVSS/min與0.45 mg N/g MLVSS/min)(圖3b)。因此,Cu2+的加入顯著增強了亞硝酸鹽的還原,從而減少了NO2?積累隨著Cu2+的加入,N2OR的活性從0.047(對照組)增加到0.124 mg N/g MLVSS/min(圖3a),而NOR的活性幾乎與對照組相同(0.244對0.264 mg N/g MLVSS/min)(圖3b)。因此,很容易理解,當添加100μg/L的Cu2+后,N2OR的活性提高2.63倍時,N2O的生成大大降低。
Cu2+對活性污泥中反硝化菌群落的影響
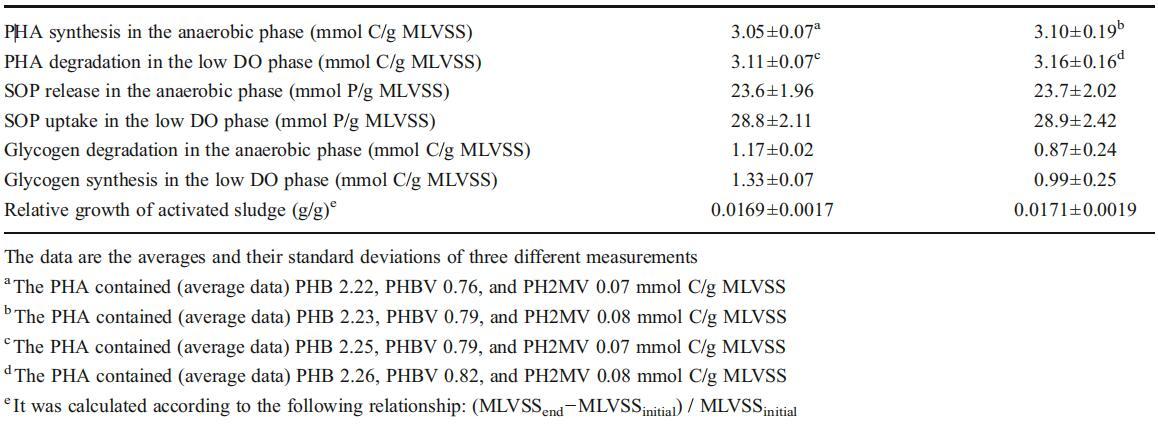
nirS、nirK和nosZ基因在編碼反硝化過程中的關鍵酶(如亞硝酸鹽還原酶和氧化亞氮還原酶)中起著至關重要的作用,這些酶可以催化NO2的還原?到NO,最后到N2(Tavares等人,2006年)。因此,根據文獻(Geets等人2007年;Henry等人2006年),針對nirS、nirK和nosZ基因的定量實時PCR分析可用于確定反硝化細菌的豐度。圖4說明了添加Cu2+后nirS、nirK和nosZ基因拷貝的變化。觀察到,添加Cu2+后,nirS和nirK基因拷貝數分別從6.07×106和1.17×106拷貝/g MLVSS增加到6.91×106和1.32×106拷貝/g MLVSS,表明本研究中的反硝化菌數量通過添加低劑量的Cu2+顯著增加(p<0.05)。對照和添加Cu2+的反應器中的nosZ拷貝數分別為7.66×106和9.03×106拷貝/g MLVSS(圖3)。顯然,在添加100μg/L Cu2+后,負責N2O還原的反硝化菌數量顯著增加(p<0.05)。

圖3 Cu2+(100μg/L)對NiR和N2OR(a)以及NAR和NOR(b)活性的影響。誤差條表示三種不同測量的標準偏差
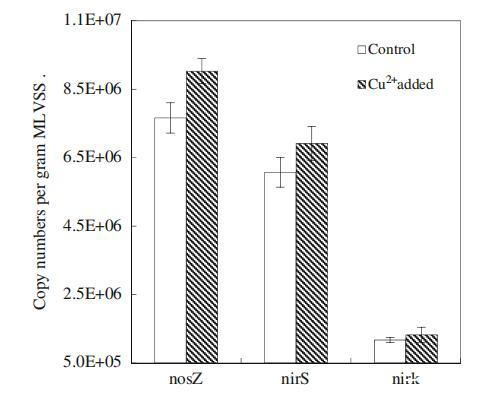
圖4 Cu2+對nosZ、nirS和nirK基因拷貝的影響。誤差條表示三種不同測量的標準偏差
另外兩種BNR工藝在城市污水處理過程中通過控制Cu2+濃度減少N2O排放的可行性
在另兩種由實際城市廢水供給的BNR工藝(AAA SBR和MAAA SBR)中,研究了Cu2+對減少N2O排放的影響。在AAA SBR和MAAA SBR中TN和TP的去除效率以及N2O的生成相對穩定后,報告了數據(見表3)。
表3其他兩種BNR SBR中N2O生成和NH4+-N、TN和TP去除效率的比較
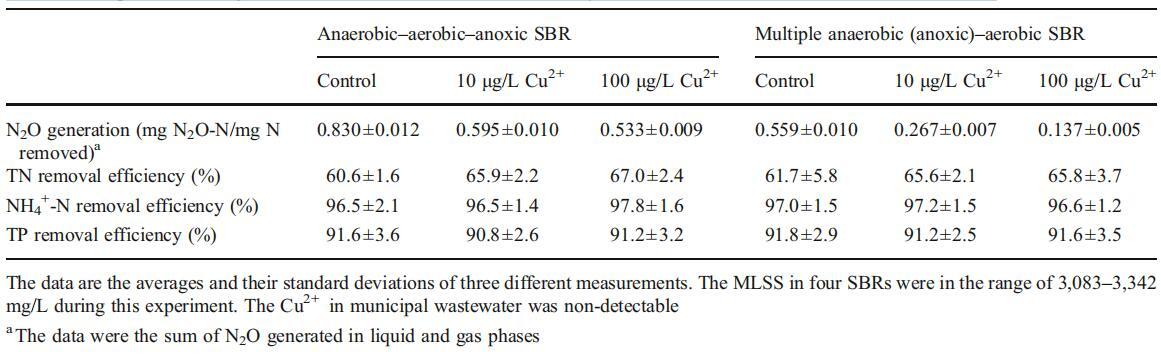
在AAA-SBR和MAAA-SBR的對照反應器中,生成的N2O去除率分別為0.830和0.559 mg N/mg N,當Cu2+濃度為10μg/L時,去除率分別降至0.595和0.267 mg N/mg N,TN去除率分別從60.6%提高到67%(p<0.05)和61.7%提高到65.8%(p<0.05)。Cu2+從10μg/L增加到100μg/L后,N2O的生成量分別降低到0.533(AAASBR)和0.137 g/L(MAAA-SBR),TN去除效率沒有顯著影響(p<0.05)。從表3可以看出,與對照組相比,添加10或100μg/L的Cu2+不會顯著影響NH4+-N和TP的去除效率。當采用厭氧-低溶解氧BNR工藝處理廢水時,所有這些觀察結果幾乎與上文討論的結果相同。因此,可以得出結論,通過將廢水Cu2+濃度控制在10至100μg/L,減少城市污水生物處理過程中N2O的生成是可行的。
據報道,反硝化菌stutzeri會產生缺乏銅的非活性N2O還原酶(Mokhele等人,1987年)。研究還發現,與缺銅培養物相比,增加斯圖澤里梭菌和反硝化副球菌培養物中的Cu2+濃度導致N2O氣體積累減少和生長加速(Granger和Ward 2003)。從本研究中可以看出,通過將Cu2+濃度控制在10–100μg/L,不僅可以顯著減少厭氧-低溶解氧生物廢水處理過程中N2O的生成54.4–72.4%,而且可以提高TN的去除效率,而不會對NH4+-N和TP的去除產生不利影響。然而,正如在其他研究中觀察到的那樣,過量的Cu2+(5000μg/L)對BNR微生物有毒(Ganesh等人,2010年;Wu和Rodgers,2010年)。根據美國環境保護局(2010)的研究,在較低的pH值(<6.5)下,游離銅的毒性水平可能會抑制硝化作用,在較高的pH值(7–8)下,痕量游離銅(100μg/L是最佳濃度)可能會加速硝化作用。在本研究中,pH值在7到8之間變化(電子補充材料,圖S9)。因此,當前研究中10–100μg/L的Cu2+的存在應有利于硝化。然而,未觀察到Cu2+對硝化的加速作用,可能是因為對照SBR中的氨氮去除效率高達97%。
數據(圖1和2b)表明,當只有少量NO2累積時,SBR中N2O的排放率在有氧期的第一個小時內較低(低于0.1μmol/min)(SBR#5除外)?-檢測到N。然后,在接下來的1.5小時內,隨著NO2的積累,N2O的排放速率增加?-N、一些研究人員報告說,NO2的積累?-由于亞硝酸鹽或亞硝酸鹽形成的HNO2的毒性抑制了N2O向N2的還原反應,氮在生物脫氮過程中誘導了N2O的積累(Itokawa等人,2001年;Zhou等人,2008年)。亞硝酸鹽積累也被認為是自養硝化菌反硝化的原因,其最終產物是N2O(Kampschreur等人,2007年)。據報道,pH值是影響N2O生成的另一個重要因素。Th?rn和S?rensson(1996)發現,pH值高于6.8時,缺氧活性污泥中不會形成N2O。當pH值在5到6之間時,N2O產生量最大。在當前研究中,添加Cu2+(100μg/L)的SBR在一個循環中的pH變化與對照SBR中的pH變化幾乎相同(電子補充材料,圖S9)。因此,影響N2O排放的因素,包括溶解氧、pH、COD/N、SRT和溫度,在六種SBR中是相同的,這表明NO2的減少?在低溶解氧階段通過添加Cu2+積累是降低N2O生成的重要原因。
形成亞硝酸銅還原酶催化中心的銅離子已在大量反硝化菌中被報道(Tavares等人,2006),其耗盡可抑制亞硝酸鹽還原酶的合成(Zumft 1997)。如本研究所示,在活性污泥處理廢水過程中,添加Cu2+可以顯著提高NiR活性,從而減少NO2?反硝化累積。
在本研究中,觀察到在污泥濃度(MLSS)約為3200 mg/L的厭氧-低溶解氧BNR工藝處理廢水期間,添加Cu2+可提高N2OR活性,在Cu2+濃度為100μg/L時觀察到其最大活性(電子補充材料,圖S10)。N2OR是一種含雙核電子轉移位點CuA和催化位點CuZ的銅蛋白(Pomowski等人,2011年)。CuA中心被認為接受來自電子供體(c型細胞色素和/或假天青蛋白)的電子,并將其轉移到N2OR蛋白質另一亞單位的相鄰CuZ位點,其中N2O結合并還原為N2和水(Pomowski等人,2011)。銅離子是純反硝化細菌N2O還原酶生物合成的控制因素(Iwasaki等人,1980年),銅離子缺乏會導致反硝化污泥的N2OR活性非常低(Miller等人,2009年)。因此,觀察表明,當添加適量的Cu2+時,較高的N2OR活性會導致BNR過程產生較少的N2O。
對活性污泥中nosZ、nirS和nirK基因的實時定量分析表明,添加Cu2+促進了反硝化菌的生長。Pieja等人(2011年)報告稱,含有甲烷單加氧酶(一種需要銅的酶)的I型甲烷諾菌的生長可以通過降低培養基中的Cu2+濃度來限制。Granger和Ward的研究表明,當以N2O為基質時,純反硝化細菌反硝化細菌在富銅培養基中的生長速率是在缺銅培養基中的6倍。這些結果表明,銅離子可能是銅依賴性細菌生長的一個必要因素。還觀察到,一些反硝化菌不包含編碼N2O還原酶的基因,例如根癌農桿菌C58,這些反硝化菌的最終產物是N2O(Baek等人,2008)。因此,NO2的減少?通過添加Cu2+積累N2O不僅是由于較高的NIR和N2OR活性,而且還直接受到反硝化菌數量增加的影響,尤其是能夠還原N2O的反硝化菌。
表2中的數據表明,在低溶解氧階段,用于糖原合成的PHA消耗較少,而用于反硝化的PHA節省較多,這導致添加Cu2+的反應器中的TN去除效率高于對照反應器(60.6%對70.8%)。通過添加Cu2+改善TN去除的另一個原因是參與反硝化反應的關鍵酶和微生物增加(圖3)。據報道,糖原積累生物(GAO)90%的反硝化最終產物是N2O,這是導致BNR過程中N2O排放增加的主要原因(Lemaire等人,2006;Meyer等人,2005;Zeng等人,2003)。曾等(2003)指出,在BNR系統中,糖原的轉化越少,GAO的活性越弱。因此,結果表明,銅離子可能會抑制GAO的活性(見表2),這可能是添加銅的反應器中產生較低N2O的另一種可能機制。
在文獻中,當研究生物脫氮除磷時,合成廢水或城市廢水中的Cu2+濃度通常低于10μg/L(Buzier等人,2006;Zeng等人,2003)。根據本研究結果,從控制N2O排放和促進總氮去除的角度來看,BNR工藝進水中的Cu2+濃度始終不足。此外,本研究發現,約98.6%的進水Cu2+被去除,出水中的Cu2+含量低于2μg/L。美國環境保護局(2007)指出,公有處理廠排放濃度為40-200μg/L的Cu2+不應對水生物種構成威脅。
在通過厭氧-低溶解氧工藝處理廢水的過程中,氮的去除會經歷硝化作用(NH4+-N被氧化為NO2?-N和NO3?-N)和脫氮(NO2?和NO3?還原為NO、N2O和N2),銅的添加顯著影響反硝化作用。此外,本研究表明,銅離子作為一種微量元素,在生物城市污水脫氮除磷過程的反硝化活性(NiR和N2OR)和群落中起著重要作用,適當的銅添加可以顯著減少N2O的生成,同時提高生物脫氮過程中的總氮去除率。
致謝
本研究得到了國家863計劃(2011AA060903)和污染控制與資源再利用國家重點實驗室的資助。